EL AGUA Y LAS SOLUCIONES
ESTADO NATURAL
El agua es indispensable para la vida, y también la sustancia más abundante en nuestro planeta. Es estado sólido la encontramos como hielo o nieve en los polos, en la cima de las montañas, en los glaciares.
En estado líquido cubre aproximadamente las tres cuartas partes de la superficie terrestre, en océanos, mares, ríos, lagos, corrientes subterráneas, etc.
Como gas, es componente fundamental de la atmósfera (humedad atmosférica).
Se calcula que la cantidad total de agua en la tierra es 1.4 x1018 toneladas, concentrada principalmente en océanos y mares. El agua dulce (ríos y lagos), sólo alcanza a unas 2x1015 toneladas, aproximadamente.
De otra parte, el agua es constituyente fundamentalmente de la meteria viva y de muchos minerales. El cuerpo humano tiene un promedio 65%, y hay vegetales cuyo contenido llega al 95%.
PROPIEDADES FÍSICO-QUÍMICAS DEL AGUA
La enorme importancia del agua se basa no solamente en su abundancia, sino en sus propiedades, que son únicas.
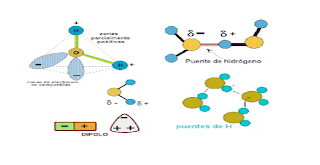
El agua es una molécula asimétrica en la cual dos átimos de hidr´geno y uno de oxigeno están unidos por enlace covalente polar.
Debido precisamente a la polaridad de las moléculas, éstas tienen tendencia a asociarse entre sí para formar una red espacial de forma pseudocristalina (no muy rígida), aun en estado líquido.
En los estados sólidos y liquido la atracción entre los átomos de hidrógeno de una molécula y los átomos de oxígeno de las moléculas vecinas las mantiene asociadas mediante puentes de hidrógeno, siendo su fórmula molecular (H2O)n, donde n= 2, 3, 4, etc., y su masa molecular un múltiplo de 18 como se ha podido comprobar mediante análisis con rayos X y por determinaciones del peso molecular
El enlace de hidrogeno es más fuerte que la atracción producida por las fuerzas de Van der Waals entre dos moléculas, pero es menos fuerte que un enlace electrovalente o covalente:
En iónico > En covalente > En de H> Fuerzas de Van der Waals
En el hielo pues, las moléculas de agua se encuentran asociadas formando una estructura en la cual cada átomo de oxígeno (excepto los que están en la superficie del cristal) está unido a otros cuatro átomos de oxígeno mediante puentes de hidrógeno; un cristal de hielo o un copo de nieve se consideran una molécula gigante (H2O)n; esto explica la menor densidad del hielo respecto al agua
Al fundirse el hielo, se rompe muchos enlaces de hidrógeno, las moléculas se van juntando, con lo cual el volumen disminuye y en consecuencia la densidad aumenta:
D= M/V
PROPIEDADES FÍSICO-QUÍMICAS DEL AGUA
El agua presenta las siguientes propiedades físico-químicas:
· ACCIÓN DISOLVENTE
El agua es el líquido que más sustancias disuelve (disolvente universal), esta propiedad se debe a su capacidad para formar puentes de hidrógeno con otras sustancias, ya que estas se disuelven cuando interaccionan con las moléculas polares del agua.
La capacidad disolvente es la responsable de dos funciones importantes para los seres vivos: es el medio en que transcurren las mayorías de las reacciones del metabolismo, y el aporte de nutrientes y la eliminación de desechos se realizan a través de sistemas de transporte acuosas.
FUERZA DE COHESIÓN ENTRE SUS MOLÉCULAS:
Los puentes de hidrógeno mantienen a las moléculas fuertemente unidas, formando una estructura compacta que la convierte en un líquido casi incompresible.
ELEVADA FUERZA DE ADHESIÓN:
De nuevo los puentes de hidrógeno del agua son los responsables, al establecerse entre estos y otras moléculas polares, y es responsable, junto con la cohesión de la capilaridad, al cual se debe, en parte, la ascensión de la sabia bruta desde las raíces hasta las hojas.
GRAN CALOR ESPECÍFICO:
El agua absorbe grandes cantidades de calor que utiliza en romper los puentes de hidrógeno. Su temperatura desciende más lentamente que la de otros líquidos a medida que va liberando energía al enfriarse. Esta propiedad permite al citoplasma acuoso servir de protección para las moléculas orgánicas en los cambios bruscos de temperatura.
ELEVADO CALOR DE VAPORIZACIÓN:
A 20°C se precisan 540 calorías para evaporar un gramo de agua, lo que da idea de la energía necesaria para romper los puentes de hidrógeno establecidos entre las moléculas del agua liquida y, posteriormente, para dotar a estas moléculas de la energía cinética suficiente para abandonar la fase liquida y pasar al estado de vapor.
ELEVADA CONSTANTE DIELÉCTRICA:
Por tener moléculas dipolares, el agua es un gran medio disolvente de compuestos iónicos, como las sales minerales, y de compuestos covalentes polares como los glúcidos.
Las moléculas de agua, al ser polares, se disponen alrededor de los grupos polares del soluto, llegando a desdoblar los compuestos iónicos en aniones y cationes, que quedan así rodeados por moléculas de agua. Este fenómeno se llama solvatación iónica.
PROPIEDADES BIOQUÍMICAS DEL AGUA
Los seres vivos se han adaptado para utilizar químicamente el agua en dos tipos de reacciones:
a) En la fotosíntesis en la que los enzimas utilizan el agua como fuente de átomos de hidrógeno.
b) En las reacciones de hidrólisis, en que los enzimas hidrolíticos han explotado la capacidad del agua para romper determinados enlaces hasta degradar los compuestos orgánicos en otros más simples, durante los procesos digestivos.
IONIZACIÓN DEL AGUA Y ESCALA DE pH
Si observas la figura siguiente, comprobarás que dos moléculas polares de agua pueden ionizarse debido a las fuerzas de atracción por puentes de hidrogeno que se establecen entre ellas.
Un ion hidrógeno se disocia de su átomo de oxigeno de la molécula (unidos por enlace covalente), y pasa a unirse con el átomo de oxígeno de la otra molécula, con el que ya mantenía relaciones mediante el enlace de hidrógeno.
Como vemos, el agua no es un líquido químicamente puro, ya que se trata de una solución iónica que siempre contiene algunos iones H3O+ y OH- . (Se utiliza el símbolo H+, en lugar de H3O+).
El producto [H+]·[OH-]= 10-14, se denomina producto iónico del agua, y constituye la base para establecer la escala de pH, que mide la acidez o alcalinidad de una disolución acuosa , es decir, su concentración de iones [H+] o [OH-] respectivamente. Definimos el pH como:
pH=-log[H+]
Química general e inorganica 10. Felix A. Manco L.Octava Edición. 2001



No hay comentarios:
Publicar un comentario